Най-добрият начин да се изобрази атом е чрез компактно ядро, около което се въртят „жужащи“ електрони. Тази картина веднага води до въпроса как електроните продължават въртенето си, без да „падат“ в ядрото.
Това бил един от най-сложните въпроси през 20. век, а търсенето на неговия отговор в крайна сметка довело до възникването на квантовата механика. В началото на миналото столетие учените тепърва сглобявали пъзела, свързан със смислено представяне на устройството на атома. Те установили, че атомът има плътно, тежко, положително заредено ядро, заобиколено от облак дребни по размер, отрицателно заредени електрони. След тези общи наблюдения логично било те да създадат и един по-подробен модел.
При първите варианти те почерпили вдъхновение от устройството на Слънчевата система, която също има плътно „ядро“ (Слънцето), заобиколено от малки „частици“ (планетите), но този модел породил два сериозни проблема.
Най-напред, всяка заредена частица, която има ускорение, отделя електромагнитна радиация.
Това се отнася изцяло и за електроните. Както се вижда в статия на университета в Ноксвил, Тенеси (http://labman.phys.utk.edu/phys222core/modules/m6/production_of_em_waves.html), това отделяне на радиация би трябвало да доведе до загуба на енергия и бързо, спираловидно движение надолу и сблъсък на частицата с ядрото. Малко след 1900 г. учените установили, че би отнело по-малко от една трилионна от секундата (1 пикосекунда), преди това да се случи. Очевидно имало грешка в модела, при положение че атомите съществуват много по-дълго.
Някога се смятало, че електроните обикалят около ядрото така, както планетите обикалят слънцето. Тази представа била променена от съвременната квантова механика.
Второ, оказало се, че въпросът с радиацията е твърде специфичен. Учените знаели, че електроните излъчват радиация, но на определени честоти, а ако моделът за Слънчевата система бил верен, те щели да излъчват радиация на всички честоти – нещо, което противоречало на наблюденията.
Квантовата „поправка“
Известният датски физик Нилс Бор пръв предложил решение на тази загадка. През 1913 г. той предположил, че електроните не могат да обикалят около ядрото на произволно разстояние, а всеки се движи по конкретна орбита (https://www.nobelprize.org/prizes /physics/1922/bohr/facts/). Бор смятал и че съществува минимална дистанция от ядрото, която електроните трябва да спазват.
Тези идеи, разбира се, не му хрумнали току-така. Около десетилетие по-рано немският физик Макс Планк бил открил, че вероятно частиците излъчват и приемат енергия на „кванти“ – точно определени количества, които не се променят (http://hyperphysics.phy-astr.gsu.edu/hbase/mod6.html), но имат минимална стойност, по-малка от която не съществува. Тази минималнo възможна стойност на енергията, която електроните отдават или приемат, била наречена константа на Планк. Дотогава учените смятали, че частиците излъчват радиация на всички честоти.
Константата на Планк има същите стойности като ъгловия момент, т.е. момента на обект, който се движи в кръг. Затова Бор приложил идеята върху обикалящите в кръг електрони, като постулирал, че най-малката възможна орбита на електрон около ядрото е равна на ъгловия момент на една единица от константата на Планк. По-големите орбити следователно се равняват на две, три и повече единици от константата на Планк, т.е. орбитите не са произволни стойности, а произведения на константата с цяло число.
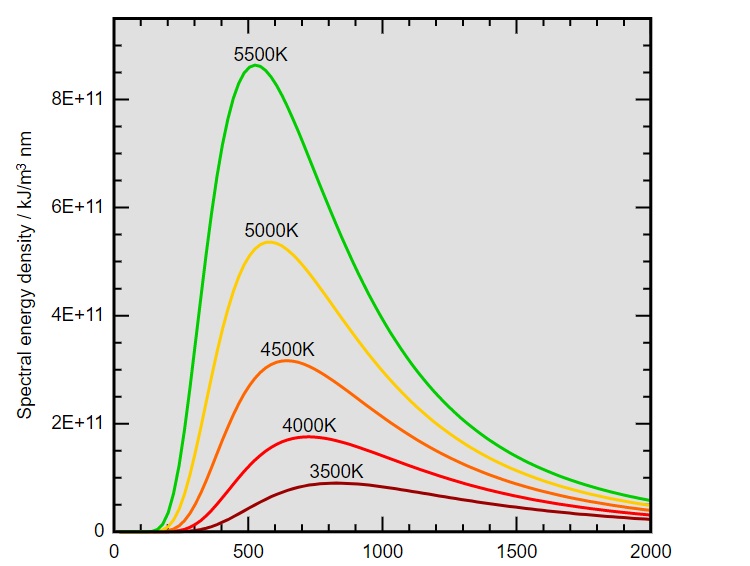
Интензитет на светлината, излъчвана от черно тяло. Всяка крива представлява поведение при различни телесни температури. Константата на Планк h се използва за обяснение на формата на тези криви.
Отнело доста време, докато квантовата механика се развие напълно като наука и се установи защо електроните имат такава минимална орбита и точно определени по-големи орбити.
Електроните, както и всички частици материя, се държат едновременно като частици и като вълни. Може да си представим еднакво добре електрона като мъничка планета, обикаляща ядрото, но и като вълна, която обгръща това ядро. Вълните в такова ограничено пространство (confined space) се подчиняват на специални правила – те не могат да имат произволна дължина и трябва да се състоят от стационарни (стоящи) вълни, които точно се побират в пространството. Също като при свирене на музикален инструмент: ако забодем краищата на струната, в нея се побират само вълни с определена дължина, които произвеждат определен тон, определена нота. По подобен начин електронната вълна трябва да пасва на мястото, а най-малката орбита на електрона съответства на неговата първата, най-къса стационарна вълна.
По-нататъшното развитие на квантовата теория дава още по-съвършена картина на проблема, но основното разбиране не се променя: електронът не може да се доближи повече до ядрото, защото неговата квантова природа не му позволява да заеме по-малко пространство.
Сумата от енергиите
Има обаче и съвсем различен начин да се разгледа ситуацията и той няма нищо общо с квантовата механика. Просто се вгледайте в енергиите, които участват тук. Електронът, който се върти в орбита, бива непрекъснато привличан електрически от ядрото, но същевременно той има кинетична енергия, която се стреми да го отблъсне надалеч. При един стабилен атом тези две сили са в равновесие. Всъщност общата енергия на електрон, който се движи по орбита, се състои от кинетична и потенциална компонента и е отрицателна. Това означава, че ако искаме да отделим електрона, трябва да прибавим енергия към атома. Подобно е положението с планетите в Слънчевата система – ако искаме да изтласкаме навън някоя от тях, трябва да добавим енергия в системата.
За да разберем по-добре ситуацията, трябва да си представим, че електронът „пада“ по посока на ядрото, привлечен от неговия противоположен електрически заряд. Поради правилата на квантовата механика обаче той остава завинаги „заклещен“ в орбита, без да може да достигне ядрото. А това е възможно, тъй като общата енергия на системата е отрицателна, т.е. системата е стабилна и елементите ѝ са взаимообвързани, като така образуват трудно разрушимия атом.
Превод: Здравко Минчев

